 重要通知 :
重要通知 :
- 乐鱼乐鱼体育官网登录是一家有着二十多年制刷经验,在本地区较早从事毛刷生产的厂家之一,乐鱼体育官方直营门户网站主要加工生产各种工业机械
- 配套用的毛刷、毛刷辊、条刷、密封毛刷、机械刷辊、清洗刷辊、尼龙刷辊、钢丝刷辊、钢丝辊、海绵吸
- 水辊,条形刷,圆盘刷,毛刷板,弹簧刷、内绕弹簧刷、扫雪刷片、扫路刷,毛刷条,海绵辊等异型毛刷、
- 工业毛刷、刷辊及配件,品种达百余种。

致力于高品质毛刷辊 皮带清扫器 钢丝辊的研发生产和销售!

 重要通知 :
重要通知 :
原标题:科研进展 I 扬州大学刘秀梵团队:新城疫病毒HN蛋白通过诱导溶酶体膜通透性诱导细胞凋亡

溶酶体是介导细胞废物降解和回收的酸性细胞器,被称为细胞的“自杀袋”。溶酶体损伤可导致溶酶体膜通透性 (LMP) 并引发不一样的细胞死亡,包括细胞凋亡。新城疫病毒(NDV)被认为是全球家禽业中最严重的病原体之一。此外,它更是一种很有前途的溶瘤病毒,以其有效感染肿瘤细胞和诱导强烈的凋亡反应而闻名。然而,对溶酶体参与 NDV 诱导的细胞凋亡仍然知之甚少。在这里,作者证明NDV感染触发LMP,导致组织蛋白酶B和D的易位以及随后在各种肿瘤和禽细胞中的线粒体依赖性细胞凋亡。NDV依靠病毒HN蛋白的唾液酸酶活性来水解LAMP1和LAMP2聚糖链末端的唾液酸残基。导致溶酶体腔内 CTSB 对 LAMP1 和 LAMP2 的去糖基化和降解,随后触发 LMP和细胞凋亡。这些发现揭示了NDV诱导的细胞凋亡的新机制,并为开发基于NDV的溶瘤疗法提供了宝贵的见解。
为了研究NDV感染是否诱导LMP,作者首使用Lysotracker Red和Acridine Orange染色检查其对溶酶体酸化和溶酶体膜通透性的影响。发现NDV感染可能在不同的肿瘤和禽细胞中诱导溶酶体脱酸,导致溶酶体膜通透化(图1A-E)。为了验证这些发现,作者随后通过半乳糖凝集素点状测定,发现NDV 感染导致半乳糖凝集素 3 从细胞质和细胞核中的弥漫分布重新分布为点状模式,与细胞中的 LAMP1(溶酶体膜标志物)精确共定位(图1F和G)。进一步证明NDV感染会触发各种肿瘤和禽细胞中的溶酶体膜通透化。

LMP 通常导致溶酶体组织蛋白酶(CTSB和CTSD)从溶酶体转移到细胞质。为了探索 NDV 感染对 CTSB 和 CTSD 亚细胞定位的影响,发现NDV感染后细胞中LAMP1和LAMP2的表达水平逐渐下降,促使CTSB和CTSD从溶酶体释放到胞质(图2A-G)。同时,作者利用共聚焦显微镜进一步评估发现,NDV感染时CTSB和CTSD蛋白逐渐扩散在整个胞质中,导致与LAMP3的共定位显着减少图(2H-K)。因此,以上根据结果得出NDV感染会触发不同肿瘤和禽细胞中的LMP,导致CTSB和CTSD从溶酶体腔渗漏到细胞质。

结果2:LMP 通过 CTSB 和 CTSD 诱导线粒体功能障碍,促进 NDV 诱导的细胞凋亡
泄漏的溶酶体组织蛋白酶与各种细胞死亡途径的调节有关,包括细胞凋亡、坏死、铁死亡和焦亡。本文作者主要对LMP在NDV诱导的细胞凋亡中的作用上进行研究。作者将Herts/33 病毒感染细胞 24 小时,然后用 CA-074(CTSB 特异性抑制剂)和胃蛋白酶抑制剂 A(Pep A,一种天冬氨酸蛋白酶抑制剂)再处理 6 小时,发现 CA-074 和 Pep A 的治疗对病毒 NP 蛋白水平没有显着影响,但显著抑制了 NDV 诱导的细胞凋亡(图3A-F)。为了进一步证实 LMP 介导的促凋亡作用,作者靶向si-CTSB和 si-CTSD的siRNA发现,敲除 CTSB 或 CTSD 对病毒 NP 蛋白没有显着影响,但显着抑制 NDV 诱导的细胞凋亡图(3G-M).这些发现强烈表明,LMP 通过参与 CTSB 和 CTSD 促进 NDV 诱导的细胞凋亡。
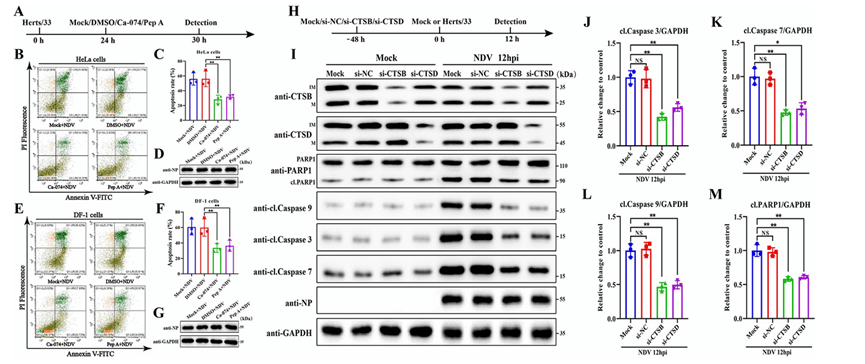
LMP 后,易位组织蛋白酶通常会导致线粒体损伤,导致通过线粒体途径细胞凋亡。鉴于上述发现,作者旨在研究LMP是否通过线粒体途径促进NDV诱导的细胞凋亡。发现NDV感染导致Bcl-2降低,Bax 从细胞质到线粒体的易位,促进了细胞色素 C 释放,(图4A-G),而 CTSB 和 CTSD 的敲除显着阻止了这些过程(图4H-O).表明 LMP 依靠 CTSB 和 CTSD 介导线粒体功能障碍并诱导线粒体通路依赖性细胞凋亡,最终促进 NDV 诱导的细胞凋亡。

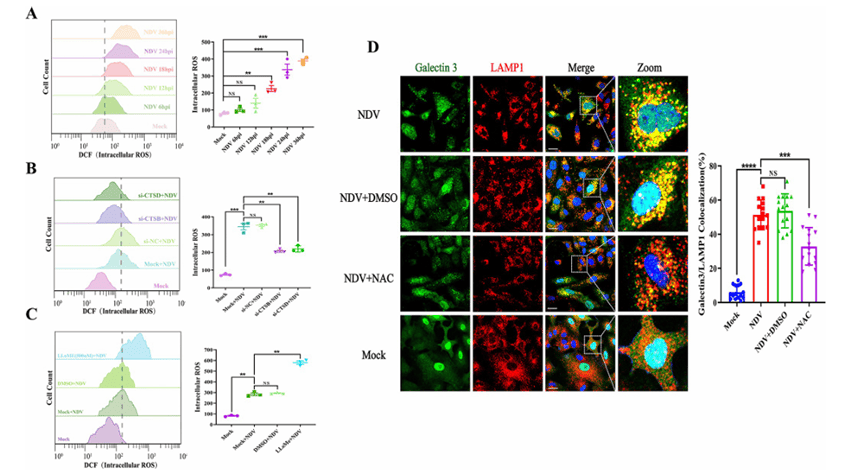
线粒体功能障碍破坏了ROS产生和抗氧化防御之间的平衡,导致ROS释放增加。鉴于 ROS 在维持溶酶体膜完整性方面的关键作用以及上述发现,表明 NDV 诱导的 LMP 通过 CTSB 和 CTSD 促进线粒体功能障碍。作者假设 CTSB 和 CTSD 通过在 NDV 感染期间诱导 ROS 的产生进一步加剧 NDV 诱导的 LMP。为了验证这一假设,作者通过流式细胞术分析测量了NDV感染期间的ROS水平。结果显示,NDV感染后ROS水平随时间依赖性显着增加(图5A),用抗氧化剂 N-乙酰基-L-半胱氨酸 (NAC) 治疗可显着降低 NDV 感染后 LMP 的程度(图5D),以及ROS水平的降低。这些根据结果得出,NDV感染诱导ROS的产生,进而促进NDV诱导的LMP。同时,作者进一步探讨了 LMP 是否有助于 NDV 感染期间 ROS 的产生增加。根据结果得出,敲除 CTSB 或 CTSD 可显着降低 ROS 水平 (图 5B),而用 LLoMe 治疗可促进 NDV 感染后的 ROS 生成 (图5C),表明 LMP 有助于 NDV 感染期间 ROS 的产生。综上所述,这些发现证明了NDV诱导的溶酶体和线粒体损伤的恶性循环,其中CTSB和CTSD充当LMP的效应因子,并通过诱导线粒体功能障碍和增加ROS的产生和释放进一步加重NDV诱导的LMP。
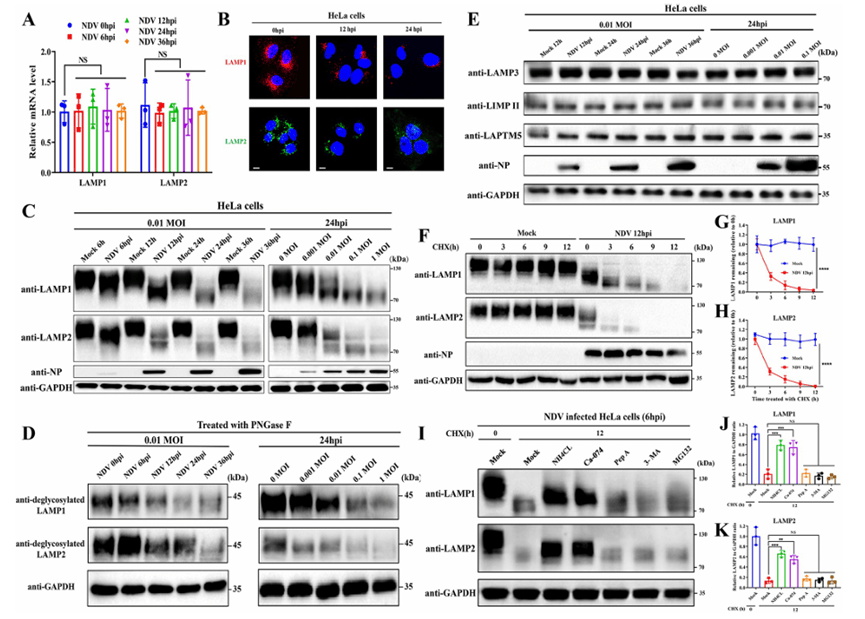
在确定LMP在NDV诱导的细胞凋亡中的作用后,作者进一步探讨NDV诱导LMP的机制。LAMP1和LAMP2是溶酶体膜的关键成分,通过溶酶体腔内高度糖基化的管腔层保护溶酶体酶免受溶酶体酶的侵害,从而维持其完整性。作者研究之后发现,NDV感染后细胞中LAMP1和LAMP2的蛋白水平呈时间和剂量依赖性降低并导致其去糖基化(图6A-C)。此外,使用糖苷酶 PNGase F 的测定表明,在 NDV 感染后,除了蛋白质去糖基化外,蛋白质本身的表达水平也会降低,表明去糖基化参与了 LAMP1 和 LAMP2 的降解(图6D和E).
由于 NDV 感染不影响 LAMP1 和 LAMP2 mRNA 水平,作者研究了 LAMP1 和 LAMP2 的减少是否是由于转录后调控。未解决这个问题,作者比较了用翻译抑制剂环己酰亚胺 (CHX) 处理后 NDV 感染细胞中 LAMP1 和 LAMP2 的蛋白水平。如图6F–6H,与NDV感染后的对照细胞相比,在CHX处理的细胞中观察到LAMP1和LAMP2蛋白显着减少,表明LAMP1和LAMP2的转录后蛋白降解增加。为了表征 LAMP1 和 LAMP2 蛋白降解的潜在机制,我们测量了 CHX 联合溶酶体酸化抑制剂 NH4CL、CTSB 抑制剂 CA-074、天冬氨酸蛋白酶抑制剂 Pep A、自噬抑制剂 3-甲基腺嘌呤 (3-MA) 或蛋白酶体抑制剂 MG132 处理的 NDV 感染 HeLa 细胞中 LAMP1 和 LAMP2 蛋白的减少。根据结果得出,与仅用 CHX 处理的细胞相比,用 NH4CL 或 CA-074 处理显着抑制了 LAMP1 和 LAMP2 的降解,而 Pep A、3-MA 和 MG132 表现出最小的效果(图6I–6K).这一根据结果得出,NDV诱导的LAMP1和LAMP2降解依赖于溶酶体酸化和CTSB活性。总之,这些发现表明NDV感染导致LAMP1和LAMP2的去糖基化和随后的降解。该过程通过转录后机制发生,并依赖于溶酶体酸化和 CTSB 活性。
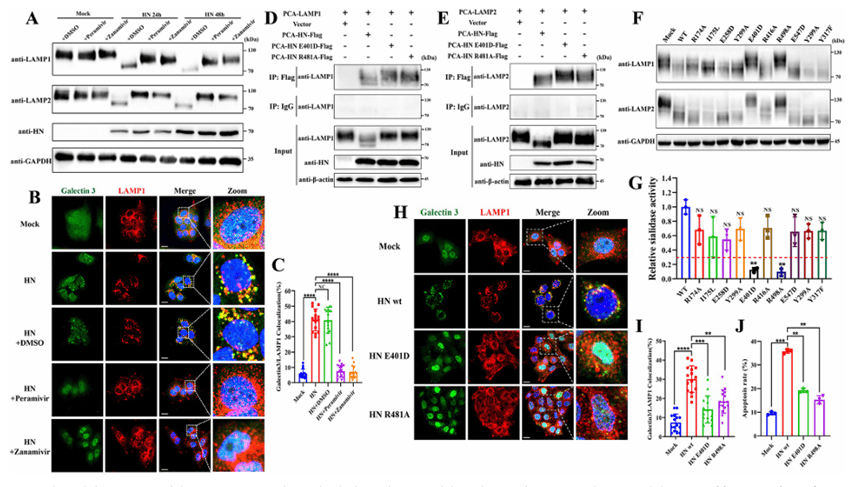
为了阐明 NDV 诱导的 LAMP1 和 LAMP2 去糖基化的分子基础,作者将表达病毒结构蛋白(NP、P、M、F、HN、L 蛋白)或非结构蛋白(V 和 W 蛋白)的质粒转染到 HeLa 细胞中,并分别确定它们对 LAMP1 和 LAMP2 表达的影响。如图7A-D,仅用 HN 蛋白转染导致 LAMP1 和 LAMP2 的去糖基化和降解。免疫共沉淀和共聚焦显微镜检测结果为,HN 蛋白与 LAMP1和 LAMP2共定位 (图7E-H),突出了HN蛋白在NDV诱导的细胞凋亡中的关键作用。
为了确认 HN 蛋白诱导的 LMP 和细胞凋亡是否依赖于 LAMP1 和 LAMP2 的去糖基化和降解,作者过表达或敲低 LAMP1 和 LAMP2,并评估了 HN 蛋白转染后的 LMP 和细胞凋亡率。蛋白质印迹法证实了过表达和敲低的效率(图 7K).半乳糖凝集素 3 点和膜联蛋白 V-FITC/PI 检测显示 LMP (图 7I 和 7L)和细胞凋亡率(图7N)在 LAMP1 和 LAMP2 过表达时被抑制,而敲低这些蛋白会增加 LMP 的形成 (图 7J 和 7M)并促进细胞凋亡(图 7O).这些结果共同支持了病毒 HN 蛋白通过直接与 LAMP1 和 LAMP2 相互作用,导致其去糖基化和降解,在 NDV 诱导的 LMP 和细胞凋亡中起关键作用的观点。

结果6:HN 蛋白的唾液酸酶活性介导 LAMP1 和 LAMP2 的去糖基化和降解
唾液酸是唯一参与蛋白质糖基化修饰的单糖,带有负电荷。它通常位于糖链的末端,在维持糖蛋白的构象中起着至关重要的作用。LAMP的适当唾液酸化可促进其稳定性并增强溶酶体功能,而去唾液酸化会增加其对溶酶体降解的易感性,从而缩短半衰期。考虑到唾液酸化修饰在维持LAMPs稳定性中的关键作用,作者试图研究HN蛋白是否通过其唾液酸酶活性介导LAMP1和LAMP2的去糖基化和降解。
作者首先评估了两种唾液酸酶活性抑制剂帕拉米韦和扎那米韦对 HN 蛋白诱导的 LAMP1 和 LAMP2 去糖基化和降解的影响。发现帕拉米韦或扎那米韦处理可显着抑制 HN 蛋白转染后 LAMP1 和 LAMP2 的去糖基化和降解以及降低的 LMP 水平(图8A-C).为了进一步研究唾液酸酶活性在 HN 蛋白诱导的 LMP 中的作用,作者确定了 Herts/33 菌株 HN 蛋白中有助于其唾液酸酶活性的关键氨基酸位点。将其突变后,发现 E401D和R481A突变最显著地降低了HN蛋白的唾液酸酶活性和有效地阻止了 LAMP1 和 LAMP2 的去糖基化和降解 (图8D-E)。最后,作者研究了这两个突变对HN蛋白诱导的细胞LMP和细胞凋亡的影响。根据结果得出,HN蛋白突变体表现出诱导LMP的能力显着降低和细胞凋亡(图8H-J)与野生型 HN 蛋白相比。以上这些发现表明,HN蛋白的唾液酸酶活性对于LAMP1和LAMP2的去糖基化和降解至关重要,最后导致不同NDV菌株感染期间的细胞LMP和细胞凋亡。
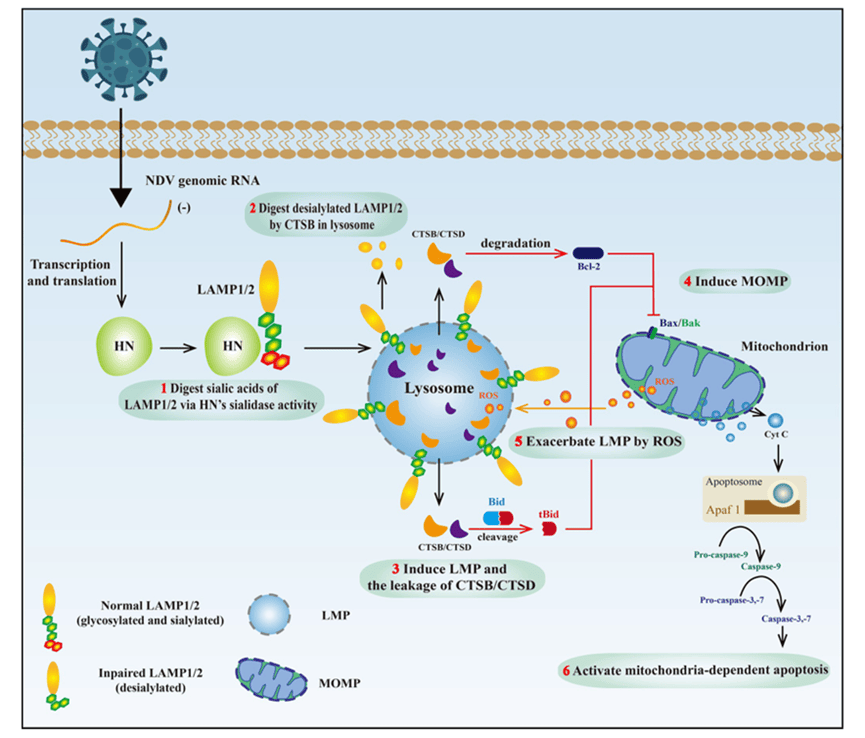
综上所述,作者在本研究中发现NDV利用HN蛋白的唾液酸酶活性水解LAMP1和LAMP2的唾液酸残基,导致它们的去糖基化,随后在溶酶体腔内被CTSB降解,触发LMP。随后,CTSB 和 CTSD 易位到细胞质,最后导致线粒体依赖性细胞凋亡。揭示了NDV感染、LMP和细胞凋亡之间错综复杂的相互作用,强调了靶向这些过程的抗病毒策略和开发基于NDV的溶瘤剂的潜力。